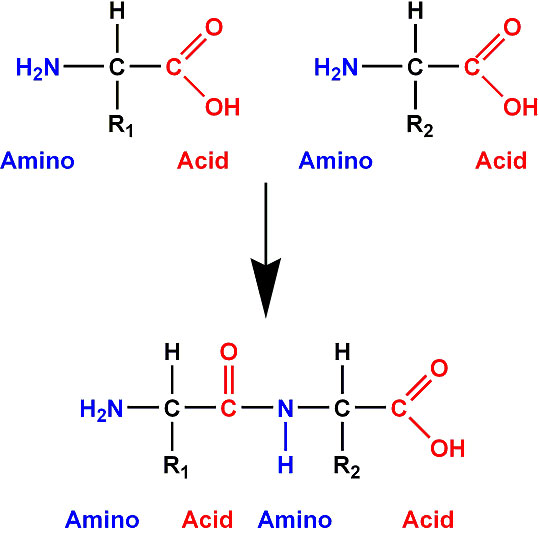
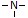No momento em
No entanto, essa molécula de água produzida não estabelece propriamente a ligação peptídica, uma vez que ela é eliminada, sendo assim, a união entre dois aminoácidos consiste numa reação de condensação (ou síntese por desidratação). A ligação peptídica efetivamente ocorre entre o carbono (C) de um aminoácido e o nitrogênio (N) do aminoácido vizinho, classificada como ligação covalente (C-N).
As moléculas que se formam a partir da ligação de aminoácidos são conhecidas como peptídeos. Logo, dois aminoácidos compõem um dipeptídeo, três formam um tripeptídeo, quatro produzem um tetrapeptídeo e assim sucessivamente. Para simplificar esses nomes podem ser usados os termos oligopepídeos para designar moléculas formadas por aminoácidos (do grego oligo, pouco) e polipeptídios, para denominar moléculas compostas por muitos aminoácidos (do grego poli, muitos). Uma proteína, portanto, pertence à categoria dos polipeptídios, já que são constituídas por um número expressivo de aminoácidos.

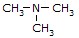 (trimetanoamina)
(trimetanoamina)